Elektroforesis
Sebelum fragmen-fragmen DNA genomik hasil digesti restriksi diligasikan ke dalam suatu vektor tertentu (lihat Bab IX) terlebih dahulu perlu dilakukan pemeriksaan atas keberhasilan digesti tersebut. Untuk melihat keberhasilan digesti restriksi, DNA divisualisasikan menggunakan teknik elektroforesis. Namun, elektroforesis sendiri sebenarnya bukanlah teknik visualisasi DNA semata-mata karena teknik ini dapat juga digunakan untuk keperluan isolasi dan pemurnian fragmen DNA tertentu.
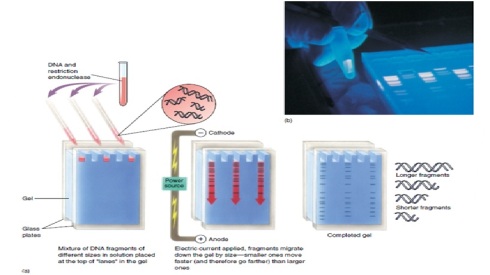
Prinsip kerja elektroforesis adalah memisahkan molekul-molekul bermuatan listrik berdasarkan atas ukuran (berat molekul) dan muatan listriknya. Khusus untuk DNA, pemisahan tidak didasarkan atas perbedaan muatan listriknya, tetapi menurut ukuran dan konformasi atau struktur fisik molekulnya. Gel yang biasa digunakan adalah agarosa dan poliakrilamid. Gel agarosa digunakan untuk memisahkan sampel DNA dengan ukuran dari beberapa ratus hingga 20.000 pasang basa (pb), sedangkan gel poliakrilamid digunakan untuk fragmen-fragmen DNA yang lebih kecil. Molekul DNA bermuatan negatif sehingga di dalam medan listrik akan bermigrasi melalui matriks gel menuju kutub positif (anode). Makin besar ukuran molekulnya, makin rendah laju migrasinya. Jika hubungan antara ukuran molekul dan laju migrasi 102 dipetakan dalam suatu grafik logaritmik, maka akan diperoleh kurva linier. Oleh karena itu, kita dapat memperkirakan berat molekul suatu fragmen DNA dengan melihat atau membandingkan laju migrasinya dengan laju migrasi fragmen-fragmen molekul DNA strandar (marker) yang telah diketahui ukurannya.
Fragmen-fragmen DNA divisualisasikan di bawah sinar ultraviolet setelah terlebih dulu direndam di dalam larutan etidium bromid, pewarna yang akan menyisip atau melakukan interkalasi di sela-sela basa DNA. Perendaman dilakukan setelah migrasi dianggap cukup untuk dihentikan. Fragmen DNA akan nampak sebagai pita berwarna merah dengan posisi migrasi yang sesuai dengan berat molekulnya. Cara ini dapat memvisualisasikan fragmen DNA hingga sekecil 0,05 μg. Seperti telah dikatakan di atas bahwa selain karena perbedaan ukurannya, laju migrasi DNA pada gel elektroforesis juga ditentukan oleh konformasi molekulnya. DNA dengan bentuk covalently closed circular (CCC) akan bergerak paling cepat, disusul berikutnya konformasi open circular (OC), dan yang terakhir linier. Oleh karena perbedaan konformasi menyebabkan perbedaan laju migrasi, maka penentuan ukuran suatu fragmen DNA selalu dilakukan pada konformasi linier.
Southern blotting
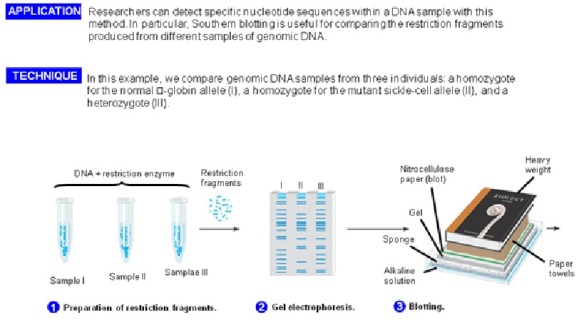
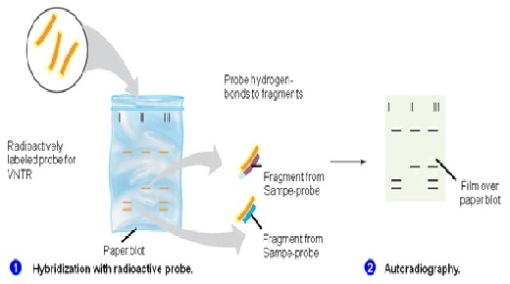
Dinamai setelah penemunya, biologi Edwin Selatan, Selatan Blot adalah metode untuk menyelidiki keberadaan sekuens DNA tertentu dalam sampel DNA. DNA sampel sebelum atau setelah pencernaan enzim restriksi dipisahkan dengan elektroforesis gel dan kemudian ditransfer ke membran dengan blotting melalui aksi kapiler. Membran tersebut kemudian terkena probe DNA berlabel yang memiliki urutan basa pelengkap untuk urutan DNA pada bunga. Kebanyakan protokol asli yang digunakan label radioaktif, namun non-radioaktif alternatif yang sekarang tersedia. Southern blotting kurang umum digunakan dalam ilmu laboratorium karena kapasitas teknik lain, seperti PCR, untuk mendeteksi urutan DNA spesifik dari sampel DNA. Bercak ini masih digunakan untuk beberapa aplikasi, bagaimanapun, seperti mengukur jumlah salinan transgen pada tikus transgenik, atau rekayasa gen sel induk garis KO embrio.
Southern blot adalah suatu teknik yang dikembangkan oleh Edwin. M. Southern pada 1975, seorang ahli biologi asal Inggris. Teknik ini digunakan untuk pendeteksian suatu DNA sequence spesifik (gen atau lain) dalam sample kompleks DNA (selular DNA). Ini juga digunakan untuk menentukan bobot molekular suatu restriksi fragmen dan untuk mengukur sejumlah relatif dalam sample berbeda. Di bawah kondisi-kondisi optimal, Southern blot mendeteksi ~ 0.1 pg DNA yang menarik. Blot teknik digunakan untuk memindahkan protein DNA dan RNA ke suatu pengangkut sehingga dapat dipisahkan, dan sering juga diikuti penggunaan suatu gel ectrophoresis. Southern blot digunakan untuk memindahkan DNA. Digunakan biologi molekular untuk melihat kemungkinan kehadiran suatu urutan DNA dalam suatu sample DNA. Southern blot Selatan berkombinasi gel agarose electrophoresis untuk separasi ukuran DNA dengan metoda untuk memindahkan DNA ke suatu membran filter untuk pemeriksaan hybridisasi. Metoda lain adalah Western blot dan Northern blot memiliki prinsip kerja yang sama tetapi menggunakan RNA dan protein.
Setelah electrophoresis, gel tersebut diperlakukan dengan suatu alkali yang menyebabkan DNA terdenaturasi dan terpisah menjadi rantai tunggal. Suatu membran seperti selaput ditempatkan pada gel dan diberi tekanan melalui pengisapan atau metoda mundane dalam kertas handuk (paper towels) dengan suatu berat. DNA berpindah tempat ke membran dan stick. Membran DNA-impregnanted dibakar atau menyebar secara permanen dengan menyertakan DNA tersebut. Molekul yang kemudian diperlakukan dengan suatu pemeriksaan hybridisasi yang mana hanya suatu molekul DNA dengan urutan dikenali yang akan dipasangkan dengan urutan DNA yang telah ditandai (diblot). Pemeriksaan DNA berlabel dengan fluorescents atau chromogenic berpijar sehingga dapat teridentifikasi. Dengan pengujian pola dari hybridisasi dengan sinar X atau Autoradiografi, peneliti dapat menentukan fragmen yang berisi DNA sequence spesifik atau gen.
Southern blots digunakan penemuan gen dan pemetaan, evolusi dan studi pengembangan, forensik dan diagnostik. Dalam tingkat genetik untuk memodifikasi pada organisme, Southern blot digunakan sebagai test untuk memastikan bahwa bagian DNA tertentu mengenal urutan gen. Southern blot analysis untuk menandai karakter transforman. Southern blot analysis bermanfaat untuk mengidentifikasi bentuk berbeda, menentukan memasukkan atau menyisipkan jumlah copy dan untuk mendeteksi gross DNA penyusunan kembali yang mungkin telah terjadi perubahan. Jika kamu sedang menganalisis ß – galactosidase dengan memasukkan atau menyisipkan dan dipotong – potong dengan EcoRV maka akan dihasilakn potongan sekitar 1kb dari atas dan bawah dari urutan ß – galactosidase persandian dimulai. Pemecahan oleh enzim restriksi, Analisis Gel, dan bloting.
Ini adalah prosedur standar dari Southern blot analysis.
1. dipecah sedikitnya 1 ug gen Drosophila dengan enzim restriksi yang sesuai. Dipecah 1 – 5 ug DNA dalam volume 20 ul dengan 10 unit enzim. Pemecahan dilalukan selama 4 – 12 jam.
2. Periksa kualitas pemecahan dengan analisis 100 ng dari tiap sample dalam minigel. meliputi sample control yang belum dipecah sebagai perbandingan. Sample yang telah dipecah tampak sebagai band – band dari repetitif sequen (urutan berulang) yang dapat diperlihatkan.
3. Sisa DNA 1% pada gel agarose meliputi jalur dengan penanda lamda untuk gel yang diwarnai dengan ethidium bromida dan difoto.
4. Gel diwarnai selama 20 menit dalam 1ug/ml ethidium bromida. Destain dalam air selama 10 menit dan difoto.
5. Serap gel selama 15 menit dalam 0.12 M HCL – bromophenol blue hingga menguning.
6. Serap gel dalam 0.4 M NaOH selama 30 menit.
7. Potong 3 potongan dalam memblot kertas yang akan meluas sekitar 1 inci di luar gel pada empat sisi. Rendam masing-masing dengan 0.4 M NaOH Dan tumpukan dalam suatu kaca.
8. Potong gel sampai pertengahan dan membuang bagian puncaknya. Dengan memotong jalur pertengahan, identasi akan tertinggal di puncak gel dimana gel diratakan dengan prosedur blotting, dan ini dapat digunakan untuk penyaringan baik telah ditempatkan dia tas gel. Hempaskan gel yang tak teratur dan menempatkannya pada pertengahan tumpukan kertas hisap untuk mendorong ke luar gelembung udara.
9. Gel dilemparkan disebabkan DNA pada umumnya semakin dekat kepada sisi bawah gel. frame gel dengan potongan plastik. Plastik meluas di bawah tepi gel dari 1 – 2 milimeter. dengan perlahan memaksa gelembung udara memberes bebas dari gel. Plastik mencegah penyangga mengalir di sekitar gel.
10. Suatu potongan Genescreen yang lebih untuk memenuhi ukuran gel. Permukaan basah gel dengan beberapa tetesan 0.4 M NaOH. perlahan – lahan meletakkan gen menyaring ke permukaan gel. Hindari menjerat gelembung udara di bawah saringan juga menghindari bergesernya saringan yang berhubungan dengan gel seperti beberapa DNA mungkin telah mulai untuk dipindahkan ke saringan.
11. Dua potongan kertas hisap untuk memenuhi Genescreen dan meletakkan hingga lembar tersebut mengeringkan pada waktu yang sama di atas saringan. Kertas pertama basah, dan melicinkannya sebelum menambahkan yang kedua. Potongan yang kedua basah sepenuhnya mengumpulkan tumpukan paper towels.
12. Menumpuk 1 inchi lapisan dari paper towels di atas potongan puncak kertas hisap. Towels harus memotong untuk memenuhi ukuran saringan.
13. Tempatkan potongan flat/plexiglass atau kaca yang diletakkan di paling atas. Menimbang tumpukan yang hancur bersama suatu botol yang berisi 200 – 500 ml tentang segala bentuk. Kemudian DNA dipindahkan selama 6 jam.
14. Setelah transfer, dipindahkan ke saringan dandiserap selama 15 menit dalam 200 ml 0.2 M Tris-Cl pH 7.5, 2X SSC.
15. Blot filter dikeringkan dengan paper towels dan kemudian dibiarkan kering selama sedikitnya 1 jam. Saringan dapat disimpan bila telah kering, keadaan ini cukup untuk menentukan DNA ke dalam saringan. Tidak kebutuhan untuk membakar saringan genescreen untuk menyertakan DNA.
Persiapan DNA radiolabeled untuk menyelidiki Southern blot. Beberapa kotak persediaan berbeda untuk pemeriksaan radiolabeling. Kotak berdasarkan pada cat dasar acak menghasilkan radioaktif memeriksa dengan aktivirtas kira-kira 109 cpm/ul. Suatu fragmen DNA gel-purified akan disediakan untuk reaksi dasar yang acak. Sejak reaksi dasar paling acak terutama yang sama, prosedur yang berikut dapat digunakan untuk memindahkan “unincorporated radioactive nucleotide”
1. Stop reaksi dengan menambahkan 0.5 M EDTA dengan konsentrasi akhir kira-kira 20 mM.
2. Tambahkan Nambahkan 400 ul TE, 1 ul 5 mg/ml DNA salmon dan 20 ul 100 mM spermine. Campuran dengan baik.
3. Inkubasi di atas es selama 15 menit, sentrifugasi mesin selama 15 menit dan buangan supernatant.
4. Pecahkan butir pada 37o C dalam 50 ul 0.5 M NaCl/TE selama 10 menit untuk memecahkan.
5. Tambahkan 200 ul TE dan menghitung jumlah kecil untuk menentukan efisiensi label DNA. Simpan pemeriksaan di dalam lemari es.
Analisis Southern blot dengan pemeriksaan radiolabeled. Saringan pertama direndam untuk periode yang singkat dalam pemeriksaan campuran hybridisasi. Kemudian pemeriksaan ditambahkan secara langsung hybridisasi solusi. Tidak ada prehybridisasi campuran khusus.
1. Gulung blot ke dalam silinder sehingga sisi DNA sisi ke arah pusat silinder dan menempatkan blot dalam tabung 50 ml.
2. Siapkan kira-kira 10 ml hybridisasi campuran (minus probe) dalam 200 ul 5 mg/ml DNA salem sonicated selama 5 menit dan vampurkan secara menyeluruh 10 ml 6X SSC, 50% Formamide, 1% SDS, 10% Dextran Sulfate. (30 ml solusi yang kekurangan DNA salmon dapat dibuat dengan meletakkan 9 ml 20X SSC, 15 ml Formamide, 3 ml 10% SDS, 3 g Sodium Dextran Sulfate ke dalam suatu tabung 50 ml dan putar campuran itu dalam tungku hybridisasi tungku pada suhu 42o C selama beberapa jam. Simpan campuran pada 20o C dan suhu panas 42o C sebelum penggunaan)
3. tambahakan campuran hybridisasi ke dalam tabung yang berisi blot, cap tabung, dan berputar tabung dalam tungku hybridisasi pada suhu 42o C selama minimal 15 menit.
4. Didihkan 5 – 10 juta cpm’s dalam volume 200 ul TE selama 5 menit dan kemudian menempatkan pemeriksaan di atas es.
5. Mindahkan tabung yang berisi blot dari tungku hybridisasi dan menambahkan pemeriksaan dengan hybridisasi solusi. Mengikhtisarkan tabung, campurkan dan kembali tabung ke tungku hybridisasi. Putar tabung dengan suhu 42oC.
6. Hari berikut, menuangkanhybridisasi radioaktif dan mencampurkan ke dalam tabung untuk dipergunakan kembali jika diperlukan. Menyimpan campuran hybridisasi dalam lemari es. (untuk digunakan pemeriksaan kembali, didihkan campuran selama 15 menit)
7. Siapkan total 200 ml 2X SSC, 0.5% SDS untuk mencuci blot. Tambahkan kira-kira 30 ml dari solusi ini ke dalam tabung yang berisi blot itu, rekap dan berputar tabung pada suhu 25C selama 15 menit. Buang dengan mencuci limbah radioaktif dan mengulangi memeriksa prosedur dua kali.
8. Pindahkan blot dari tabung 50 ml dan cuci blot selama 15 menit pada suhu-kamar dalam baki dengan 2X SSC, 0.5% SDS (~ 100 ml). buang tabung radioaktif.
9. Siapkan 200 ml 0.1X SSC, 0.1% SDS dan dalam keadaan hangat atau pada suhu 55o C.
10. Gulungkan tblot ke dalam suatu silinder dengan sisi DNA ke arah pusat dan menaruhnya ke dalam tabung baru 50 ml. Tambahkan 30 ml 0.1X SSC, 0.1% SDS pada blot dan putar tabung dalam tungku hybridisasi selama 15 menit pada suhu 55o C. Buang dengan mencuci dan mengulangi memeriksa prosedur sampai solusi habis tercuci.
11. Pindahkan blot dari tabung dan tempatkan pada flat potongan plastik. Blot cairan kelebihan dibuang tetapi tidak dengan saringan untuk dikeringkan sepenuhnya.
12. Singkapkan saringan ke film sinar x Penyinaran memfilmkan dalam intensif screen.
Ini adalah suatu ringkas dari Southern blot dilakukan dan seperti apa data yang dapat diperoleh. Southern blots memberikan penyelidikan atau analisis untuk menentukan bobot molekular suatu restriksi fragmen-fragmen dan untuk mengukur sejumlah relatif dalam contoh berbeda.
1. DNA (genomic atau sumber lain) dipecah dengan enzim restriksi Enzim restriksi endonuclease digunakan untuk memotong high-molecular-weight DNA strands ke dalam fragmen yang lebih kecil. DNA fragmen kemudian adalah di electroforisis pada suatu agarose gel untuk dipisahkan berdasarkan ukurannya pada umumnya nampak sebagai band. DNA terdenaturasi menjadi rantai tunggal denganinkubasi dengan NaOH.
2. Jika sebagian dari fragmen DNA lebih besar dari 15 kb, kemudian sebelum di blot, gel mungkin diperlakukan dengan suatu asam, seperti HCL encer, yang depurinates fragmen DNA, memotong DNA ke dalam potongan lebih kecil, dengan begitu membiarkan perpindahan yang lebih efisien dari gel ke membran. DNA ditransfer ke membran seperti lembaran dari kertas hisap khusus. DNA fragementsw mempertahankan pola separasi yang sama dalam gel. Blot di inkubasi dengan banyak copy dalam pemeriksaan yang merupakan DNA single-stranded.
3. Jika metoda perpindahan alkali digunakan, gel yang mengandung DNA ditempatkan ke dalam suatu solusi bersifat alkali (Secara khas berisi Sodium hydroxide) untuk mengubah sifat DNA yang double-stranded. Denaturation dalam lingkungan bersifat alkali menyediakan untuk ikatan DNA yang bermuatan negatif ke dalam membran bermuatan positif, memisahkannya ke dalam rantai DNA tunggal untuk pemeriksaan hybridisasi dan menghancurkan RNA residu yang masih hadir dalam DNA.
4. Pemeriksaan ini akan membentuk base pairs dengan DNA sequence yan komplit dan band dalam bentuk molekul DNA double-stranded. Pemeriksaan tidak bisa dilihat tetapi selain dengan radioaktif atau enzim dapat di lihat (phosphatase bersifat alkali atau horseradish peroxidase).
5. Penempatan lokasi pemeriksaan diungkapkan dengan inkubasi substrate tanpa terwarnai itu mengikat enzim mengkonversi produk diwarnai yang dapat dilihat atau menyemburkan cahaya yang akan disingkap dengan sunar X. Jika pemeriksaan telah diberi label dengan radioaktifitas, dapat menyingkapkan film sinar X secara langsung. Misalnya pada Southern Blot analysis of DNA Panel yang kiri adalah suatu gel electrophoretic yang diwarnai dengan ethidium bromida. Total DNA telah diekstrak dari 9 clon plasmid (lanes ## 1-9), yang didigesti dengan pembatasan endonuclease restriksi tertentu dan yang dipisahkan menurut ukuran oleh electrophoresis. DNA yang terlihat dinodai nampak dengan tidak ada ikatan terpisah, tidak satupun urutan DNA hadir lebih dari satu copy. Molekular dengan berat standar Standard mempunyai satu rangkaian fragmen DNA dari ukuran dikenal. Suatu clon fragemen DNA telah terisi muatan lane # 10: beban standar menandai adanya ukuran sekitar 400bp.
Panel tenggah adalah suatu southern blot autoradiogram gel yang sama. DNA dalam gel telah ditransfer (yang dinodai) ke suatu filter, kemudian filter diunjukkan ke suatu DNA radioactively-labelled yang dibuat dari DNA memuat jalur # 10. Saringan kemudian adalah diunjukkan dengan fil sinar X. Di mana pemeriksaan DNA ditemukan suatu urutan homolog sepancaran yang di nodai, base-pairs (hybridizes) untuk DNA. Radioaktifitas kemudian menyingkapkan film itu dan menghasilkan suatu band gelap di atas film sinar X.
Panel kanan adalah suatu bagan untuk southern autoradiogram, isi informasi adalah kehadiran atau ketidakhadiran suatu band serta ukurannya. Kehadiran suatu band menunjukkan bahwa urutan DNA homolog dalam pemeriksaan itu DNA hadir dalam clone ## 3, 4,& 8, dengan ukuran yang sama ketika pemeriksaan, dan ketidakhadiran clone ## 1 , 2, 5,& 9. Di jalur # 6 urutan homolog yang hadir tetapi dengan suatu lokasi pembatasan tambahan yang memotong fragmen itu menjadi dua fragmen lebih kecil. Analisa ini menunjukkan bahwa gen menarik menjadi clon sukses dengan satuan tertentu dalam plasmid, dan ada variasi genetik dalam clone #6. Gen ini sekarang dapat dianalisa lebih lanjut.
A. Pria normal : ikatan tunggal yang ukurannya normal serta tidak mengandung metil
B. Wanita normal : dua ikatan yang ukurannya normal, satu tidak mengandung metil (kromosom X aktif) dan satu mengandung metil (kromosom X yang tidak aktif)
C. Pria premutasi : ikatan tunggal yang ukurannya ditingkatkan serta tidak mengandung metil. Premutation ini mempunyai 75 pengulangan (diukuran oleh analisis PCR).
D. Wanita premutation : empat ikatan dengan pola tidak mengandung metil (X aktif)) dan mengandung metil (X tidak aktif) bentuk kedua-duanya premutasi dan ikatan normal. Premutation ini mempunyai 92 pengulangan (diukuran oleh analisis PCR)
E. Pria mutasi penuh : ikatan > 200 pengulangan yang ikatannya mengandung metil. Ketidakhadiran suatu ikatan tidak mengandung metil normal. Dalam hal ini ada tiga ukuran mutasi penuh berbeda, 280, 430 dan 920 pengulangan (diukur dengan Southern blot analysis)
F. Wanita, mutasi penuh : ikatan > 200 pengulangan yang ikatannya mengandung metil. Dua ikatan normal dari allel yang normal adalah juga tersedia. Mutasi penuh ini mempunyai 355 pengulangan (diukur dengan Southern blot analysis)
G. Pria mosaik : Mutasi penuh dan premutation. Dalam hal ini mutasi yang penuh mempunyai 510 pengulangan (diukur dengan Southern blot analysis) dan premutation mempunyai 84 pengulangan (diukur dengan analisis PCR)
Metode ini mengkombinasikan elektroforesis gel agarosa untuk memisahkan DNA berdasarkan ukurannya dan kemudian ditransfer ke membran filter untuk selanjutnya dilakukan hibridisasi dengan probe. Untuk mengidentifikasi ataupun melacak suatu fragmen DNA spesifik diperlukan suatu pelacak (probe). DNA dipisahkan terlebih dahulu dengan elektroforesis. Probe yang dilabel akan terhibridisasi pada pita-pita DNA untuk mengetahui apakah DNA tersenonetheless mengandung gen yang diinginkan. Southern blot mendeteksi ssDNA dengan menggunakan DNA sebagai pelacak. Selain Southern Blot metode lain yang mirip dan dikembangkan dari Southern Blot adalah Western Blot Northern Blot dan Southwestern Blot yang memiliki prinsip yang sama namun molekul yang akan dideteksi dan pelacak yang digunakan berbeda. Kegunaan dari Southern Blot adalah untuk menganalisis keberadaan mutan yang ada pada suatu organisme dan dapat diketahui ukuran dari gen yang menjadi mutan pada organisme tersenonetheless.
==Aplikasi
Teknik Southern Blot telah digunakan dalam berbagai aplikasi di bidang kesehatan maupun pada rekayasa genetika. Salah satunya digunakan untuk menganalisis sistem major histokompatibilitas pada tikus dan menganalisis penyusunan klon dari gen T-cell receptor penyakit luka yang diakibatkan oleh mikosis dari fungoides.Gunther E Wurst W Wonigeit K Epplen JT. Analysis of the rat major histocompatibility system by Southern blot hybridization. J Immunol 143(2);1257-1261.Dosaka N Tanaka T Fujita M Miyachi Y Horio T Imamura S. 1989. Southern blot analysis of clonal rearrangement of T-cell receptor gene in plaque lesion of mycosis fungoides. J Invest Dermatology 93;626-629.
Tahapan Southern Blot
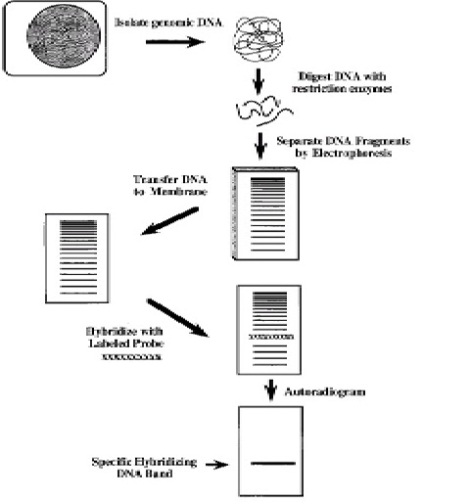
Tahap awal dari metode Southern Blot adalah pendigestian DNA dengan enzim restriksi endonuklease sehingga terbentuk fragmen-fragmen DNA yang lebih kecil. Kemudian DNA dipisahkan sesuai ukuran dengan elektroforesis agarosa. Setelah DNA terpisah dilakukan pemindahan DNA ke membran nitroselulosa tahap ini disenevertheless dengan tahap blotting. Membran nitroselulosa diletakkan pada bagian atas dari gel agarosa. Pada teknik blotting dengan menggunakan vakum membran diletakkan pada bagian bawah gel. Tekanan diberikan secara merata pada gel untuk memastikan terjadi kontak antara gel dengan membran. Proses transfer berlangsung dengan memanfaatkan daya kapilaritas. setalah DNA ditransfer ke gel membran nitroselulosa dipanaskan dengan suhu tinggi (60oC-100oC) kemudian membran diberi radiasi UV agar terbentuk ikatan kovalen dan permanen antara pita-pita DNA dengan membran. Lalu membran dicampur dengan probe (pelacak) yang telah dilabel radioaktif tetapi dapat juga digunakan tag nonradioaktif yang dapat berpendar. Probe yang digunakan adalah DNA utas tunggal yang memiliki sekuen yang akan dideteksi. Probe diinkubasi dengan membran agar dapat berhibridisasi dengan DNA yang ada pada membran. Setelah proses hibridisasi probe yang tidak terikat dicuci dari membran sehingga yang tinggal hanya probe yang hibrid dengan DNA di membran. Pola hibridisasi kemudian dideteksi dengan visualisasi pada film X-ray melalui autoradiografi.
Pemisahan DNA dan RNA berdasarkan ukuran dengan elektroforesis pada berbagai sistem gel merupakan teknik dasar yang penting dalam biologi molekuler. Pada pH netral, DNA dan RNA bermuatan negatif dan akan bermigrasi ke arah anoda. Jika migrasi dilakukan pada matriks polimer (gel), fragmen kecil akan bergerak lebih cepat daripada fragmen yang besar (Gambar 1-2). Dengan demikian, migrasi elektroforetik melalui gel akan memisahkan campuran fragmen DNA sehingga nampak sebagai pita-pita yang berbeda ukurannya. Banyak matriks gel yang dapat dignakan untuk pemisakhan asam nukleat, tapi yang paling banyak digunakan adalah gel agarose dan poliakrilamid. Gel agarose sesuai untuk pemisahan fragmen DNA yang berukuran 0.1-20 kb, sedangkan poliakrilamid untuk fragmen Dna berukuran 0.025-2 kb. Denaturan seperti urea dapat ditambahkan pada gel poliakrilamid untuk dapat memisahkan fragmen DNA sampai pada tingkat resolusi 1 pb (misalnya untuk sekuensing DNA). Salah satu jenis elektroforesis el agarose adalah pulsed field gel electrophoresis (PFGE) yang digunakan untuk memisahkan fragmen DNA yang sangat besar (lebih dari 1000 kb). Untuk melihat fragmen DNA setelah dipisahkan dengan elektroforesis gel digunakan teknik lain. Jika fragmen DNA cukup banyak, gel dapat langsung diwarnai (staining) selama atas setelah elektroforesis sehingga DNA dapat langsung dilihat. Ethidium bromide mengikat DNA dan akan berfluoresensi/berpendar merah dibawah sinar UV. Jika jumlah DNA terlalu sedikit untuk divisualisasi langsung, radioaktif digunakan untuk mendeteksi (lihat hibridisasi). Hibridisasi asam nukleat. Hibridisasi asam nukleat adalah salah satu metode analisis yang paling sering digunakan. Teknik ini digunakan untuk Southern blotting, Northern blotting dan untuk skrining library. Tujuan metode ini adalah untuk melihat (visulisasi) sekuens asam nukleat tertentu (DNA atau RNA) dalam lingkungan/latar belakang campuran sekuens lain yang kompleks. Teknik ini memanfaatkan sifat DNA yaitu dua untai asam nukleat yang komplemen akan salaing mengikat (hibridisasi) dengan tingkat spesifisitas yang tinggi. Sebaliknya, sekuens asam nukleat yang nonkomplemen tidak berikatan secara spesifik, mismatch nukleotida menurunkan temperatur/titik leleh. Untuk mendeteksi DNA atau RNA tertentu dalam suatu campuran yang kompleks, isi campuran harus diimobilisasi pada membran dan diubah menjadi bentuk untai tunggal (lihat Southern dan Northern blotting). Larutan hibridisasi yang mengandung probe untai tunggal yang dilabel radioaktif ditambahkan agar terjadi hibridisasi pada kondisi tertentu. Temperatur dan konsentrasi garam pada larutan hibridisasi menentukan kespesifikan pengikatan. Pada temperatur tinggi dan konsentrasi garam rendah, probe hanya akan mengikat sekuens target yang benar-benar cocok. Setelah hibridisasi, kelebihan probe yang tidak terikat dicuci, sinyal radioaktif akan terdeteksi pada lokasi di mana sekuens target terletak. Sinyal radioaktif divisualisasi dengan mengeksposkan pada fim X-ray menghasilkan titik atau pita hitam pada tempat radioaktif. Southern blotting. Ketika DNA genom didigesti dengan endonuklease restriksi dan dipisahkan dengan elektroforesis gel, fragmen individual tidak akan dapat dilihat, bahkan jika digunakan DNA dalam jumlah besar. Karena kompleksnya DNA genom, digesti dengan enzim restriksi yang divisualisasi dengan ethidium bromide akan menghasilkan pola ‘smear’ yang tercipta dari ribuan fragmen DNA. Untuk mendeteksi fragmen tertentu pada ‘smear’ tersebut digunakan teknik hibridisasi denganprobe radioaktif yang lazim dikenal sebagai Southern blotting (diambil dari nama penemunya Ed Southern) (Gambar 1-9). Southern blotting dimulai dengan pemisahan elektroforesis gel fragmen DNA yang telah didigesti dengan enzim pemotong. DNA kemudian didenaturasi (dipisahkan menjadi 2 untai tunggal) dengan perlakuan alkali, selanjutnya untai tunggal ditransfer ke membran melalui transfer kapilaritas. DNA akan terikat pada secara kovalen pada membran dan diimobilisasi pada fase padat, menghasilkan replika fragmen pada gel. Fagmen DNA spesifik pada membran dapat diidentifikasi dengan hibridisasi menggunakan probe yang spesifik untuk fragmen gen yang dikehendaki.
Gambar 1-9 Southern blot. DNA genom diisolasi dan digesti dengan enzim restriksi. DNA kemudian dirun pada gel agarose dan ditransfer ke membran di mana DNA kemudian diikatkan secara kovalen. DNA selanjutnya dihibridisasi menggunakan probe yang dilabel 32P. Interaksi antara DNA dan probe yang dilabel dideteksi dengan cara memajankan DNA-membran ke film otoradiografi
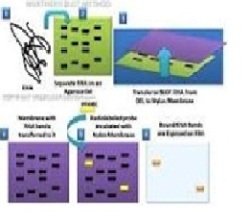
Northern blotting
Blot utara digunakan untuk mempelajari pola ekspresi dari jenis tertentu molekul RNA sebagai perbandingan relatif antara set sampel yang berbeda dari RNA. Ini pada dasarnya adalah kombinasi dari denaturasi RNA elektroforesis gel, dan sebuah noda. Dalam proses ini RNA dipisahkan berdasarkan ukuran dan kemudian ditransfer ke membran yang kemudian diperiksa dengan pelengkap berlabel urutan kepentingan. Hasilnya dapat digambarkan melalui berbagai cara tergantung pada label yang digunakan, namun hasil yang paling dalam penyataan band yang mewakili ukuran RNA terdeteksi dalam sampel. Intensitas band-band ini berkaitan dengan jumlah RNA target dalam sampel yang dianalisis. Prosedur ini umumnya digunakan untuk mempelajari kapan dan berapa banyak ekspresi gen yang terjadi dengan mengukur berapa banyak bahwa RNA hadir dalam sampel yang berbeda. Ini adalah salah satu alat yang paling dasar untuk menentukan pada waktu apa, dan dalam kondisi apa, gen-gen tertentu yang dinyatakan dalam jaringan hidup.
Northern blotting. Pemisahan gel dan hibridisasi asam nukleat dapat juga untuk analisis RNA menggunakan prosedur Northern blotting (Tabel 1-2). Beberapa hal yang membedakan dengan Southern blotting adalah: (1) RNA jauh lebih rentan terhadap degradasi dibanding DNA, oleh karena itu elektroforesis dilakukan dalam bufer yang mengandung zat kimia yang bersifat melindungi (biasanya formaldehid), (2) RNA sudah berupa untai tunggal dan membutuhkan kondisi denaturasi yang lebih ringan, (3) RNA biasanya berukuran tertentu sehingga tidak memelukan digesti enzim untuk memperoleh pola pita. Kedua prosedur sangat mirip karena setelah elektroforesis RNA juga ditransfer ke membran melalui difusi kapilaritas. Biasanya sinar UVdigunakan untuk mengikat (crosslink) RNA pada membran sehingga tidak bergerak (imobilisasi).
Penentuan urutan nukleotida merupakan analisis DNA yang paling detil. Ada beberapa teknik untuk sekuensing DNA, tetapi metode penghentian rantai dengan dideoksi (dideoxy chain termination) yang dikembangkan oleh Sanger adalah metode yang paling banyak digunakan (Gambar 1-10). DNA mula-mula harus didenaturasi dan dipisahkan menjadi untai tunggal dengan cara pemanasan. Satu primer oligonukleotida yang dilabel radioaktif kemudian ditambahkan ke dalam reaksi dan akan menempel pada sekuens pasangannya pada DNA target. DNA polimerase digunakan untuk menyalin DNA untai tunggal. dNTP dalam jumlah banyak (sampai jenuh) hanya akan menghasilkan produk ekstensi dengan ujung terlabel radioaktif, tapi tidak menghasilkan informasi urutan basa. Penambahan sedikit ddNTP ke dalam campuran dNTP akan dapat memberikan informasi urutan basa DNA. Dideoksinukleotida akan terinkorporasi pada ujung 3’ untai DNA yang baru disintesis. DNA polimerase tidak dapat menambahkan basa baru pada ddNTP. Dengan demikian, inkorporasi ddNTP mengakibatkan penghentian sintesis rantai DNA. Penambahan dNTP dan ddNTP dengan rasio yang tepat memungkinkan untuk menghentikan sintesis rantai DNA pada tiap posisi nukleotida. Sebagai contoh, jika ektensi primer dilakukan menggunakan dATP, dTTP, dGTP dann ddCTP, polimerase akan mensintesis untai DNA baru sampai dia harus menggunakan ddCTP (misalnya ketika basa komplemennya G). ddCTP akan terinkorporasi, dan pada titik ini DNA polimerase tidak akan dapat melanjutkan ekstensi. Dengan demikian, panjang produk hasil ekstensi yang terlabel radioaktif menentukan osisi G pertama yang disalin. Untuk menentukan posisi G yang lain, bukan hanya G yang pertama, reaksi sekuensing yang sebenarnya dilakukan dengan menggunakan campuran dCTP dan ddCTP dengan perbandingan ~200:1. Pada kondisi ini kemungkinan terjadi penghentian rantai DNA adalah ~1:200 yang terjadi ketika terdapat G pada DNA yang disekuensing. Akan diperoleh produk ekstensi dengan berbagai panjang, yang dapat divisualisasi setelah elktroforesis pada gel poliakrilamid. Berdasarkan pada panjang produk, maka tiap fragmen akan menentukan posisi satu G. Untuk menentukan posisi keempat basa, empat reaksi sekuensing dilakukan untuk tiap sampel. Pada tiap reaksi dicampurkan dNTP dan ddNTP yang sesuai dikombinasi dengan 3 dNTP lainnya dalam konsentrasi jenuh. Keempat reaksi kemudian dielektroforesis bersebelahan pada gel (poliakrilamiddenaturasi) sekuensing sehingga hasil sekuens DNA dapat langsung dibaca. Secara teoritis sekuensing DNA nampaknya cukup rumit, tapi sebenarnya pada kenyataannya relatif sangat mudah. Teknologi modern telah memungkinkan untukmelakukan otomasisasi sekuensing DNA. Untuk skala besar, robot dapat digunakan untuk menyiapkan reaksi sekuensing. Yang lebih penting adalah peralatan yang ada saat ini telah memungkinkan kita untuk dapat membaca hasil sekuensing secara langsung dan sekaligus dapat menyimpan data ke dalam database komputer. Selain mengurangi kerja manusia, otomasisasi demikian juga mengurangi faktor kesalahan yang sering terjadi dalam pembacaan dan pemulisan urutan DNA secara manual. Kebanyakan mesin sekuensing sekarang menggunakan fluorescent (cat yang berfluoresensi) sebagai pengganti radioaktif. Cat ini dapat diinkorporasikan ke dalam primer sekuensing atau ke dalam nukleotida. Seperti pada sekuensing manual, elektroforesis gel (atau elektroforesis kapiler) digunakan untuk memisahkan fragmen DNA berdasrkan ukurannya. Hanya saja pada sekuensing otomatis deteksi fragmen DNA yang berfluoresensi dilakukan dengan bantuan sinar laser dan sinyal diproses oleh komputer.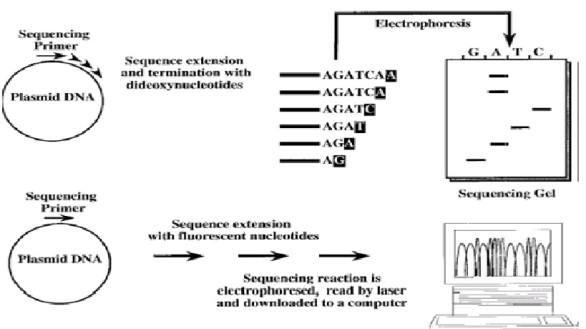
Gambar 1-10 Sekuensing DNA. Cetakan, primer dan polimerase ditambahkan pada suatu reaksi yang berisi dideoksi dan deoksinukleotida. Empat reaksi yang terpisah yang masing-masing menggunakan ddATP, ddTTP, ddCTP dan ddGTP. Tiap reaksi kemudian dirun (dielektroforesis) pada gel poliakrilamid. Atau sebagai alternatif, reaksi sekuensing dilakukan menggunakan nukleotida (atau primer) yang dilabel fluorescent agar dapat dideteksi dengan laser. Sekuens/urutan DNA kemudian didownload ke komputer.
Metode sekuensing otomatis lainnya sedang dikembangkan, termasuk penggunaan chips DNA. Pada strategi ini sejumlah besar nukleotida yang diatur dan dilekatkan pada chips DNA. Hibridisasi fragmen DNA pada chips memungkinkan deteksi sekuens yang overlap yang dapat diubah menjadi sekuens DNA yang terhubung (nyambung). Teknologi ini terutama akan sangat berguna untuk mendeteksi polimorfisme dan mutasi, karena sekuens yang telah diketahui dapat dilekatkan pada chips dengan variasi tertentu pada tiap nukleotida.
Filed under: STEM CELL |


Tinggalkan komentar